Health-Claims, Heilmittelwerbegesetz und Kosmetik-Verordnung
Das Heilmittelwerbegesetz (HWG) und die Health-Claims-Verordnung (HCVO) sollen den Verbraucher vor falschen, irreführenden oder übertriebenen Werbeversprechen bei allen Produkten, die die Gesundheit und Ernährung betreffen, schützen. Bei der Bewerbung von Kosmetik ist der Verbraucherschutz durch die Kosmetik-Verordnung geregelt.
1. Was regelt das Heilmittelwerbegesetz?
Das Heilmittelwerbegesetz regelt in insgesamt 18 Paragrafen [1] sämtliche Vorschriften zum Umgang mit Werbung für Medizinprodukte, Arzneimittel und andere therapeutische Maßnahmen sowie Eingriffe ohne medizinische Indikation. Es dient dazu, neben dem Gesetz gegen den unlauteren Wettbewerb (UWG) [2] unlautere Wettbewerbsbedingungen sowie die Täuschung von Verbrauchern zu unterbinden. Weiterhin sind die notwendigen Pflichtangaben, die Werbung für medizinische Produkte enthalten muss, hier geregelt (§ 4). Das Gesetz wurde 1965 unter dem Namen „Gesetz über die Werbung auf dem Gebiete des Heilwesens“ eingeführt.
1.1 Definition der Anwendungsbereiche
Nach § 1 kommt das Heilmittelwerbegesetztes bei folgenden Produkten zur Anwendung:
1.1.1 Medizinprodukte
Produkte mit medizinischer Zweckbestimmung und überwiegend physikalischer Wirkung, die für die Anwendung bei Menschen bestimmt sind: zum Beispiel Katheter, Herzschrittmacher, Röntgengeräte.
1.1.2 Arzneimittel
Pharmakologisch, metabolisch oder immunologisch wirkende Mittel, die bei Menschen oder Tieren angewandt werden, um Krankheiten vorzubeugen, zu lindern oder zu heilen, physiologische Funktionen wiederherzustellen oder Diagnosen zu treffen: zum Beispiel apothekenpflichtige und rezeptpflichtige Tabletten.
1.1.3 Sonstige therapeutische Mittel und Verfahren
Sonstige Mittel, Verfahren, Behandlungen und Gegenstände zur Erkennung, Beseitigung oder Linderung von Krankheiten, Leiden, Körperschäden oder krankhaften Beschwerden bei Menschen oder Tieren: zum Beispiel Physiotherapie.
1.1.4 Operative plastisch-chirurgische Eingriffe
Veränderung des menschlichen Körpers ohne medizinische Notwendigkeit: zum Beispiel Schönheitsoperationen.
1.2 Welche Werbemaßnahmen sind nach dem HWG unzulässig?
Zusätzlich zu den im UWG [2] gelisteten grundsätzlich unzulässigen Werbemaßnahmen gelten spezielle Vorschriften für die Bewerbung von Produkten, die die Gesundheit von Verbrauchern betreffen:
1.2.1 Irreführende Werbung (§ 3 und § 6)
Unter irreführender Werbung werden beispielsweise Werbemaßnahmen verstanden, die unbelegte Wirkungen behaupten oder suggerieren, Erfolge versprechen, Nebenwirkungen verschweigen und unvollständige, falsche oder falsch interpretierbare Angaben jeglicher Art in Zusammenhang mit dem Produkt oder Hersteller machen. In § 6 wird gesondert auf Werbung unter Berufung auf Quellen eingegangen.
1.2.2. Bewerbung nicht zugelassener Produkte (§ 3a)
Medizinprodukte und Arzneimittel für Menschen und Tiere müssen nach arzneimittelrechtlichen Vorschriften durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) bzw. der Europäischen Arzneimittel-Agentur (EMA) zugelassen sein, um vermarktet werden zu dürfen. Entsprechend ist Werbung für Produkte, die (noch) keine Zulassung haben, untersagt.
1.2.3 Nennung von Anwendungsgebieten bei der Bewerbung homöopathischer Mittel (§ 5)
Homöopathische Mittel, die keine Zulassung als Arzneimittel haben, sondern als homöopathisches Arzneimittel registriert oder von der Registrierung freigestellt sind, dürfen nicht mit dem Anwendungsgebiet (z. B. „bei Kopfschmerzen“ beworben werden).
1.2.4 Vertrieb über Teleshopping (§ 8)
Die Werbung für das Beziehen bestimmter Arzneimittel über das Teleshopping (§ 8) sowie für die Einzeleinfuhr von Arzneimitteln, die keine Zulassung oder Genehmigung in Deutschland haben, ist verboten (s. auch § 3a).
1.2.5 Werbung für Fernbehandlungen (§ 9)
Werbung für Fernbehandlungen, bei denen nicht direkt am Menschen oder Tier eine Diagnose erstellt oder eine Behandlung vorgenommen wird, sind bis auf genannte Ausnahmen in (§ 9) verboten.
1.2.6 Bestimmte Werbemethoden (§ 11) und Zuwendungen (§ 7)
Hierzu zählen unter anderem Werbung mit der Wiedergabe von Krankengeschichten und Meinungen Dritter, Angstwerbung (Werbung, die Konsequenzen des Nichtgebrauchs eines bestimmten Produkts vermittelt), vergleichende Werbung mit Bezug auf Konkurrenzprodukte, Preisausschreiben, Muster und Proben oder Vor- und Nachher-Bilder von Behandlungen. Auch Zuwendungen finanzieller und sachlicher Natur sowie in Form von Dienstleistungen sind bis auf die Ausnahmen in § 7 unzulässig (vgl. auch UWG [2]).
1.2.7 Publikumswerbung für bestimmte Medikamente (§ 10, § 11, 12)
Da primäres Ziel des HWG der Schutz von Verbrauchern ist, unterscheidet das Gesetz zwischen Werbung für die Öffentlichkeit und Werbung für medizinisches Fachpublikum (definiert in § 2). So dürfen Werbung für bzw. Informationen zu verschreibungspflichtigen Medikamenten und Medikamenten, die potentiell abhängig machen, in Europa nur an Personen mit Heilberuf gerichtet sein. Bereiche auf Webseiten mit Herstellerinformationen zu entsprechenden Medikamenten beispielweise, sind nur mit Zugangsberechtigung einsehbar und dürfen nicht für ein öffentliches Publikum bereitgestellt werden.
2.8 Werbung bei bestimmten Indikatoren (12 und Anlage zu § 12) außerhalb der Fachkreise
Zu diesen Indikatoren zählen meldepflichtige Krankheiten und durch meldepflichtige Infektionen ausgelöste Krankheiten, bösartige Neubildungen, Suchtkrankheiten (ausgenommen Nikotinabhängigkeit) sowie Komplikationen in der Schwangerschaft, bei der Entbindung und am Bei Tieren ausgenommen sind anzeige- und meldepflichtige Seuchen und Krankheiten, bösartige Neubildungen, bakterielle Eutererkrankungen bei Kühen, Schafen und Ziegen sowie Koliken bei Pferden und Rindern.
2. Was regelt die Health-Claims-Verordnung?
Die EU-Verordnung 1924/2006 (Health-Claims-Verordnung) [3] und [4]. Sie regelt europaweit einheitlich, mit welchen Aussagen für Lebensmittel und Nahrungsergänzungsmittel (Health Claims) geworben werden darf, um Verbraucher vor Irreführung in Gesundheitsfragen zu schützen und ungleiche Wettbewerbsbedingungen innerhalb der EU zu unterbinden. Sie wurde im Dezember 2006 eingeführt und ist seit Januar 2007 in Kraft.
2.1 Vorgaben für gesundheitsbezogene und nährwertbezogene Angaben
In der Health-Claims-Verordnung (HCVO) wird zwischen gesundheitsbezogenen und nährwertbezogenen Aussagen unterschieden, die sich wie folgt definieren:
2.1.1 Definition gesundheitsbezogene Angabe
Unter einer gesundheitsbezogenen Angabe wird nach Artikel 2 Abs. 2 Nr. 5 der Verordnung „jede Angabe, mit der erklärt, suggeriert oder auch nur mittelbar zum Ausdruck gebracht wird, dass ein Zusammenhang zwischen einer Lebensmittelkategorie, einem Lebensmittel oder einem seiner Bestandteile einerseits und der Gesundheit andererseits besteht“ verstanden. Hierzu zählen Aussagen wie „Vitamin C trägt zu einer normalen Funktion des Immunsystems bei“ (bei Erfüllung der Bedingung zulässig) oder die Aussage „Vitamin C schützt vor Erkältungen“ (unzulässig!).
2.1.2 Definition nährwertbezogene Angabe
Eine nährwertbezogene Angabe ist nach Artikel 2 Abs. 2 Nr. 4 der Verordnung „jede Angabe, mit der erklärt, suggeriert oder auch nur mittelbar zum Ausdruck gebracht wird, dass ein Lebensmittel besondere positive Nährwerteigenschaften besitzt.“ Hierzu zählen z. B. Angaben wie „fettarm“, „zuckerfrei“ oder „ballaststoffreich.“
2.2 Welche Angaben sind erlaubt?
Aussagen zu Lebensmitteln, die mit nährwert- oder gesundheitsbezogenen Angaben beworben werden, müssen wissenschaftlich bestätigt und zutreffend sein. Gemäß Artikel 10 Abs. 1 der Health-Claims-Verordnung gilt darum das sogenannte „Verbotsprinzip mit Erlaubnisvorbehalt“. Das bedeutet, dass gesundheitsbezogene Aussagen für Lebensmittel und Nahrungsergänzungsmittel grundsätzlich verboten sind, es sei denn, sie haben das Zulassungsverfahren durchlaufen und sind in der Liste der zulässigen Health Claims [3] und [4] aufgenommen. Aktuell gibt es ca. 250 zugelassene Health Claims, wobei die Liste fortlaufend aktualisiert wird. Ausgenommen von dieser Liste sind Aussagen zur Reduzierung eines Krankheitsrisikos sowie zur Entwicklung und Gesundheit von Kindern (s. 2.4).
2.2.1 Gesundheitsbezogene Angaben
Bei gesundheitsbezogenen Angaben gilt: Für Vitamine oder Mineralien können wissenschaftliche Erkenntnisse vorliegen, die eine gesundheitsbezogene Aussage erlauben. Diese sind in der Health-Claims-Verordnung (EU) Nr. 432/2012 aufgeführt [3]. Wird ein Produkt gesundheitsbezogen beworben, darf die Angabe für den Nährstoff im Wortlaut nur minimal verändert und ausschließlich eingesetzt werden, wenn die Bedingungen (s. auch [5]) für die Verwendung erfüllt sind.
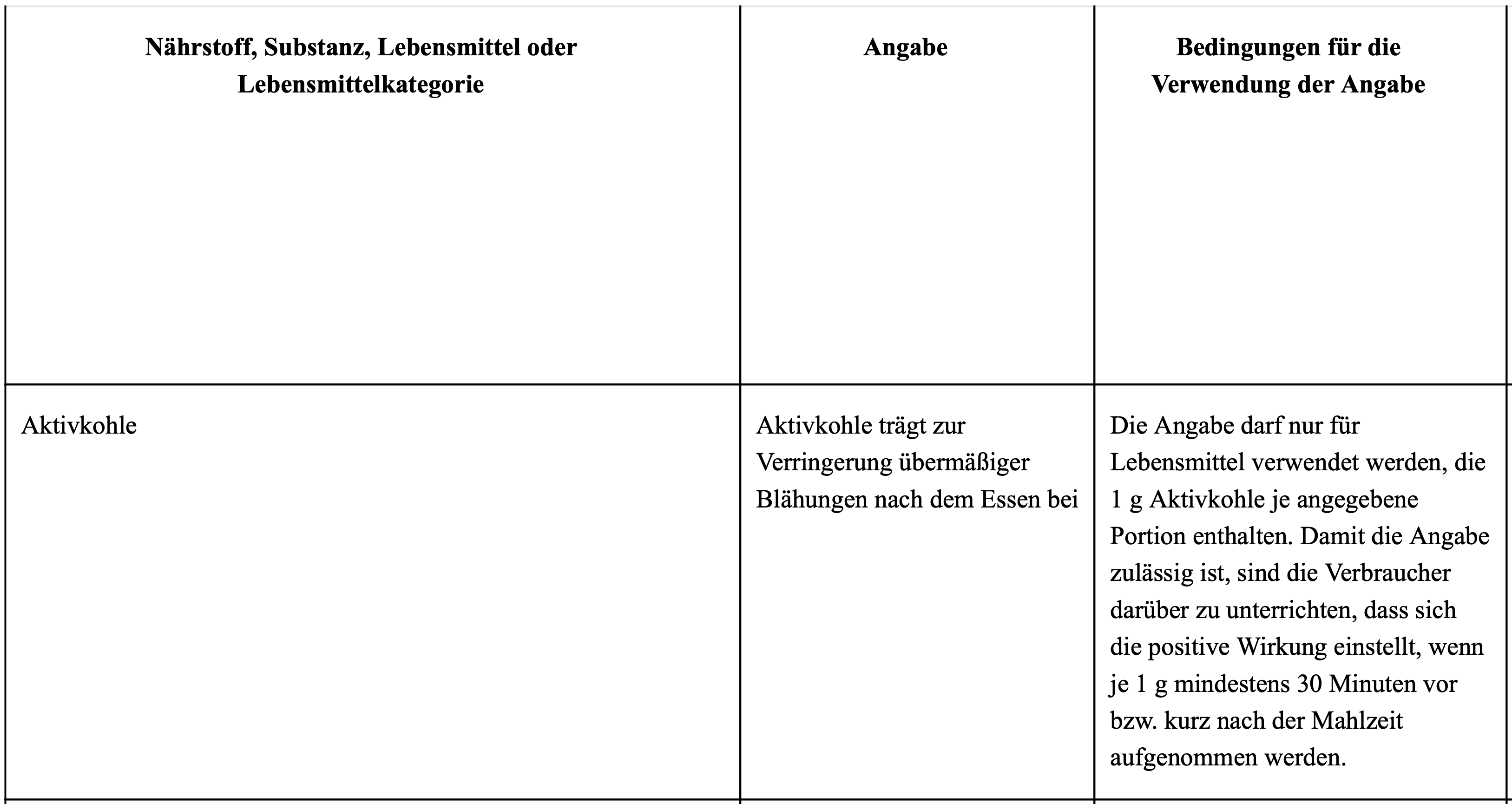
Abbildung 1: Auszug aus der VERORDNUNG (EU) Nr. 432/2012 DER KOMMISSION vom 16. Mai 2012 zur Festlegung einer Liste zulässiger anderer gesundheitsbezogener Angaben über Lebensmittel als Angaben über die Reduzierung eines Krankheitsrisikos sowie die Entwicklung und die Gesundheit von Kindern.
2.2.2 Nährwertbezogene Angaben
Nährwertbezogene Angaben dürfen verwendet werden, wenn sie die festgelegte Bedingung der im Anhang der Verordnung (EG) Nr. 1924/2006 aufgeführten Angabe [4] erfüllen.

Abbildung 2: Auszug aus der VERORDNUNG (EG) Nr. 1924/2006 DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 20. Dezember 2006 über nährwert- und gesundheitsbezogene Angaben über Lebensmittel
2.3 Was ist, wenn Aussagen oder Begriffe nicht in der HCVO aufgelistet sind?
Aus mehreren Tausend Aussagen, die Hersteller aus allen EU-Mitgliedstaaten zur Prüfung bei der Europäischen Behörde für Lebensmittelsicherheit (EFSA) eingereicht haben, sind aktuell ca. 250 gesundheitsbezogene Aussagen in der Gemeinschaftsliste zugelassen. Gesundheits- bzw. nährwertbezogene Aussagen, die nicht hier gelistet sind, sind grundsätzlich unzulässig. Die Health-Claims-Liste wird jedoch sukzessive erweitert. Es können Anträge gestellt werden, um Aussagen in die Gemeinschaftsliste nach Artikel 13 Abs. 3 zuzufügen oder um Einzelzulassungsverfahren (s. 2.4) nach den Artikeln 15 ff. in die Wege zu leiten. Für Anträge zur Prüfung einer Aufnahme nach der Verordnung (EG) Nr. 1924/2006 ist in Deutschland das BVL zuständig.
2.4 Ausnahmen der HCVO-Liste und Sonderfälle
Ausgenommen von der Gemeinschaftsliste der HCVO sind Angaben über die Reduzierung eines Krankheitsrisikos sowie Angaben über die Entwicklung und Gesundheit von Kindern. Weiterhin dürfen alkoholische Getränke nicht mit Gesundheitsaussagen beworben werden und bewegen sich Pflanzenbestandteile und neue Produkte oft in einer Grauzone.
2.4.1 Angaben über die Reduzierung eines Krankheitsrisikos
Angaben zur Reduzierung einer Krankheit werden nach Artikel 2 Absatz 2 Nr. 5 definiert als „Jede Angabe, mit der erklärt, suggeriert oder auch nur mittelbar zum Ausdruck gebracht wird, dass der Verzehr einer Lebensmittelkategorie, eines Lebensmittels oder eines Lebensmittelbestandteils einen Risikofaktor für die Entwicklung einer Krankheit beim Menschen deutlich senkt“. Ein Beispiel wäre die unzulässige(!) Behauptung „reduziert die Osteoporose-Gefahr". Um werbliche Aussagen zur Reduzierung eines Krankheitsrisikos treffen zu dürfen, müssen Antragsteller grundsätzlich Einzelzulassungsverfahren nach Artikel 15 ff. durchlaufen.
2.4.2 Angaben über die Entwicklung und Gesundheit von Kindern
Für Produkte, die sich an Kinder richten, gelten weitere Beschränkungen. Anders als bei Produkten für Erwachsene ist die Bewerbung von Lebensmitteln für Kinder zusätzlich durch ein Nährstoffprofil-Modell [6] geregelt. Darf das Produkt an Kinder vermarktet werden, müssen Antragsteller auch hier Einzelzulassungsverfahren nach Artikel 15 ff. für gesundheits- oder nährstoffbezogene Claims durchlaufen. Ein Beispiel wäre der unzulässige(!) Claim „fördert das Wachstum“.
2.4.3 Angaben für Spirituosen
Für Getränke mit einem Alkoholgehalt von mehr als 1,2 Vol.-% sind gesundheitsbezogene Angaben grundsätzlich verboten. Sie dürfen beispielsweise nicht mit Claims wie „bekömmlich“ beworben werden. Ausnahmen bilden Bezeichnungen, die traditionell für bestimmte Kategorien Alkoholika verwendet werden, zum Beispiel „Digestif“ (Bedeutung: „verdauungsförderndes alkoholisches Getränk“), „Aperitif“ (Bedeutung: „appetitanregendes alkoholisches Getränk“) oder „Magenbitter“. Für diese Ausnahmen können Unternehmen nach Artikel 1 Abs. 4 der Verordnung einen Antrag stellen.
2.4.4 Pflanzenbestandteile (Botanicals)
Während es für Vitamine und Mineralstoffe eine Liste mit zulässigen Health Claims gibt, sind bis heute kaum Aussagen zu Pflanzenbestandteilen auf Zulässigkeit geprüft. Es handelt sich hierbei noch immer um eine Grauzone, bei der bisherige Aussagen von Herstellern weiter getroffen werden.
Speziell im Fall eines Cranberry-Extrakts wurden Claims bereits als unzulässig eingestuft: Im Rahmen einer Produkteinführung wurden alle beantragten Aussagen zur gesundheitlichen Wirkung von Cranberry von der Europäischen Behörde für Lebensmittelsicherheit (EFSA) aufgrund fehlender wissenschaftlicher Belege abgewiesen (weitere Informationen).
2.4.5 Neue Produkte und Bezeichnungen
Nährwertbezogene Trend-Begriffe bewegen sich häufig zunächst in einer Grauzone. Die Bewerbung von Produkten mit diesen Claims kann jedoch schnell als unzulässig beurteilt werden, wie Gerichtsentscheidungen für die Claims „Low Carb“ und „Detox“ zeigten.
3. Was regelt die Kosmetik-Verordnung?
Die Vermarktung von Kosmetik-Artikeln unterliegt den Regeln der Kosmetikverordnung (EU) Nr. 1223/2009. Hier sind sämtliche Regeln erfasst, die Kosmetik-Produkte erfüllen müssen, um den Gesundheitsschutz von Verbrauchern zu gewährleisten und den Wettbewerb im Binnenmarkt zu regulieren. Bei der Bewerbung von Kosmetik ist zudem die Kosmetik-Verordnung Nr. 655/2013zu beachten. Diese bietet zusätzliche Richtlinien, um die Verbrauchertäuschung in der Werbung für Kosmetik-Produkte zu unterbinden.
3.1 Definition der Anwendungsbereiche
Die Kosmetik-Verordnung Nr. 655/2013 findet Anwendung bei „Werbeaussagen in Form von Texten, Bezeichnungen, Marken, Abbildungen und anderen bildhaften oder nicht bildhaften Zeichen, die sich explizit oder implizit auf Merkmale oder Funktionen eines Produkts beziehen und die bei der Kennzeichnung, bei der Bereitstellung auf dem Markt und in der Werbung für kosmetische Mittel eingesetzt werden.“ [7].
3.2 Leitlinien zu Angaben bei der Bewerbung von Kosmetik-Produkten
Es handelt sich bei der Kosmetik-Verordnung (EU) Nr. 655/2013 um genauer definierte Vorgaben zu sechs Kriterien, die Werbung für Kosmetik erfüllen muss, nämlich:
- Einhaltung von Rechtsvorschriften (Legal Compliences)
- Wahrheitstreue (Truthfulness)
- Belegbarkeit (Evidential Support)
- Redlichkeit (Honesty)
- Lauterkeit (Fairness)
- Ermöglichung einer fundierten Entscheidungsfindung (Informed decision-making)
Die ebenfalls 2013 erschienene zugehörige Leitlinie zur Verordnung (EU) Nr. 655/2013 wurde 2017 durch das Technical document on cosmetic claims ersetzt. Dieses ist jedoch kein rechtsverbindliches Produkt der Europäischen Kommission, sondern dient vielmehr als Werkzeug, um die sechs Kriterien einzuhalten und zeigt beispielhaft unzulässige Claims auf.
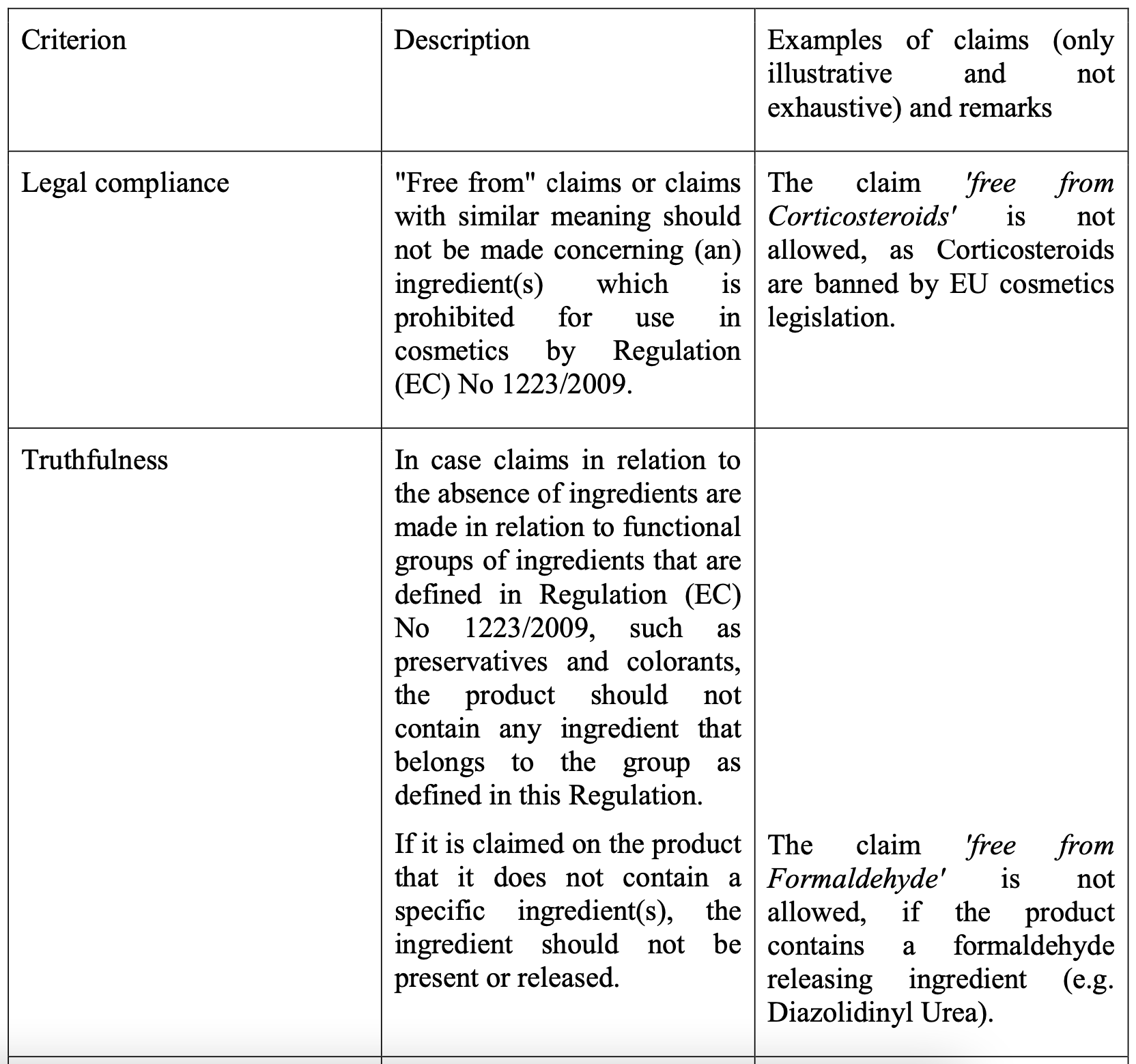
Abbildung 2 Ausschnitt aus dem Technical document of cosmetic claims
Quellen:
Heilmittelwerbegesetz und Gesetz gegen unlauteren Wettbewerb
[1] Heilmittelwerbegesetz in der Fassung der Bekanntmachung vom 19. Oktober 1994 (BGBl. I S. 3068), das zuletzt durch Artikel 6 des Gesetzes vom 28. April 2020 (BGBl. I S. 960) geändert worden ist. Abgerufen am 15.09.2020 via https://www.gesetze-im-internet.de/heilmwerbg/HWG.pdf
[2] Gesetz gegen den unlauteren Wettbewerb in der Fassung der Bekanntmachung vom 3. März 2010 (BGBl. I S. 254), das zuletzt durch Artikel 5 des Gesetzes vom 18. April 2019 (BGBl. I S. 466) geändert worden ist. Abgerufen am 15.09.2020 via https://www.gesetze-im-internet.de/uwg_2004/
Health-Claims-Verordnung
[3] VERORDNUNG (EU) Nr. 432/2012 DER KOMMISSION vom 16. Mai 2012 zur Festlegung einer Liste zulässiger anderer gesundheitsbezogener Angaben über Lebensmittel als Angaben über die Reduzierung eines Krankheitsrisikos sowie die Entwicklung und die Gesundheit von Kindern. Abgerufen am 15.09.2020 via https://eur-lex.europa.eu/legal-content/DE/TXT/HTML/?uri=CELEX:32012R0432&qid=1403863040750&from=DE
[4] VERORDNUNG (EG) Nr. 1924/2006 DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 20. Dezember 2006 über nährwert- und gesundheitsbezogene Angaben über Lebensmittel. Abgerufen am 15.09.2020 via https://eur-lex.europa.eu/legal-content/DE/TXT/PDF/?uri=CELEX:32006R1924R(01)&from=FR
[5] VERORDNUNG (EU) Nr. 1169/2011 DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 25. Oktober 2011 betreffend die Information der Verbraucher über Lebensmittel und zur Änderung der Verordnungen (EG) Nr. 1924/2006 und (EG) Nr. 1925/2006 des Europäischen Parlaments und des Rates und zur Aufhebung der Richtlinie 87/250/EWG der Kommission, der Richtlinie 90/496/EWG des Rates, der Richtlinie 1999/10/EG der Kommission, der Richtlinie 2000/13/EG des Europäischen Parlaments und des Rates, der Richtlinien 2002/67/EG und 2008/5/EG der Kommission und der Verordnung (EG) Nr. 608/2004 der Kommission. Abgerufen am 15.09.2020 via https://eur-lex.europa.eu/legal-content/de/TXT/?uri=CELEX:32011R1169
[6] WHO Regional Office for Europe nutrient profile model. Abgerufen am 15.09.2020 via https://apps.who.int/iris/handle/10665/152779
Kosmetik-Verordnung
[7] Verordnung (EG) Nr. 1223/2009 des Europäischen Parlaments und des Rates vom 30. November 2009 über kosmetische Mittel. https://eur-lex.europa.eu/legal-content/DE/ALL/?uri=CELEX:32009R1223
[8] VERORDNUNG (EU) Nr. 655/2013 DER KOMMISSION vom 10. Juli 2013 zur Festlegung gemeinsamer Kriterien zur Begründung von Werbeaussagen im Zusammenhang mit kosmetischen Mitteln. Abgerufen am 15.09.2020 via https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2013:190:0031:0034:DE:PDF
[8] Technical Document on cosmetic claims. Abgerufen am 15.09.2020 via https://ec.europa.eu/docsroom/documents/24847
Weiterführende Artikel
- https://www.bmel.de/DE/themen/ernaehrung/lebensmittel-kennzeichnung/pflichtangaben/naehrwertinformationen-health-claims.html
- https://www.verbraucherzentrale.de/wissen/lebensmittel/kennzeichnung-und-inhaltsstoffe/lebensmittel-mit-gesundheitsversprechen-11035
- https://www.verbraucherzentrale.de/wissen/lebensmittel/kennzeichnung-und-inhaltsstoffe/entscheidung-fuer-den-nutriscore-naehrwertkennzeichnung-kommt-2020-36561
Urteile zur Verwendung von Health Claims, Beauty Claims und nährwertbezogenen Angaben
- https://www.drmlegal.de/health-claims-urteile/
- https://www.it-recht-kanzlei.de/viewTopic.php?folder=715
- https://www.meyerlegal.de/pdf/newsletter-05-2019.pdf
Sie möchten Texte kaufen?
Für Unternehmen und Webmaster, die Texte kaufen wollen, empfiehlt sich die Nutzung eines Marktplatzes. content.de bietet Ihnen einen Zugriff auf mehr als 6.500 Texter mit unterschiedlichsten Fachkenntnissen. Wer zuvor Mustertexte der Texter sichten möchte, besucht den Texter-Showroom von content.de!


